一、药包材登记号查询方法:
1.查找我国国家药品监督管理局药品审评中心网站(cde.org.cn)。
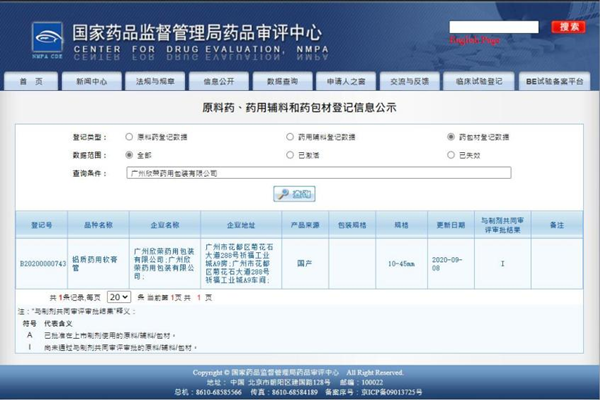
2.页面中右边“热点栏目”找到“原料药、药用辅料和药包材登记信息公示”,点击进入。
3.在登记信息公示的页面上,登记类型请选择“药包材登记数据”,查询条件则输入“广州欣荣药用包装有限公司”,查询后即可找到欣荣的药包材登记号资料,登记号为B20200000743。
二、药包材注册管理法律法规
根据《中华人民共和国药品管理法》(主席令第45号) 、《中华人民共和国药品管理法实施条例》(国务院令第360号),国家药品监督管理部门对药包材的管理已历时二十年,前后出台了3个令:
1991年5月20日,原国家医药管理局令第10号《药品包装用材料、容器生产管理办法(试行)》;
2000年4月29日,原国家药品监督管理局令第21号《药品包装用材料、容器管理办法(暂行)》;
2004年7月20日,国家食品药品监督管理局令第13号《直接接触药品的包装材料和容器管理办法》。
三、注册审评审批体制和机制
国家局(药品注册司): 注册、再注册的审批;
中检院(药用辅料及药包材室):组织技术审评;
省局(药品注册处、药品审评认证中心和省药检所):注册、再注册的受理和初审,现场检查和抽样检验。
技术审评:国家局药品注册司委托中检院药用辅料及药包材室承担;
每年召开6次专家审评会议,平均每两个月一次;
审评专家来自中检院、药包材协会及部分省级检验机构专家;省局可派观察员参加会议。
四、注册申报相关程序和要求
注册申报程序:
受理→初审→现场检查→抽样检验→技术审评→审批(批准或不批准)
注册申报要求
总体要求:
药包材生产申请、补充申请以及再注册申请,申请人应按照国家食品药品监督管理局《直接接触药品的包装材料和容器管理办法》(局令第13号)规定的资料目录,提交真实、完整、规范的申报资料。申报资料应为原件1套、复印件2套,申请表原件3份。
具体要求:
(一)申请企业营业执照:申请人营业执照应与申请表相关内容一致。
(二)申报产品生产、销售、应用情况综述: 应同时说明产品的用途及用法。
(三)申报产品的配方:应明确说明原料及添加剂的化学名称、质量标准、来源、在配方中的作用、用量以及用量比例等。提供原料和添加剂的质量标准复印件、来源厂家营业执照复印件。
(四)申报产品的生产工艺及主要生产、检验设备说明:生产工艺资料应包括工艺流程图、起始原料、有机溶媒、生产条件(温度、压力、时间、催化剂等)和操作步骤等,有洁净度要求的生产环节还应在工艺流程图中予以标注。生产、检验设备以表格形式列出,内容包括序号、设备名称、型号、数量和生产厂商。
(五)申报产品的质量标准:执行国家食品药品监督管理局颁布的YBB标准的品种,应提供所执行标准的复印件;执行自拟标准的品种,应提供标准原件和起草说明,其格式符合国家食品药品监督管理局YBB标准的格式,使用其术语和计量单位。质量标准应附产品结构图,同时申报配件的还应提交配件的质量标准等等。